Réactions d’oxydo-réduction
-
-
I- Réactions d’oxydo-réductions :
1- Expérience :
On immerge partiellement une plaque de cuivre dans une solution de nitrate d’argent (Ag+ + NO3–)

On constate la formation d’un dépôt d’agent sur la partie immergée de la plaque et on constate que la solution prend une coloration bleue caractéristique des ions Cu2+.
2- Interprétation :
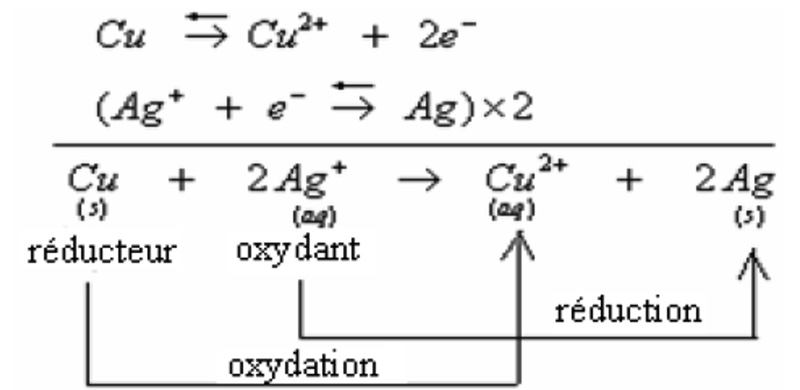
Au cours de cette transformation chimique le cuivre s’est oxydé en Cu2+ selon la demi-équation suivante:
Cu ⇆ Cu2+ + 2e–
Les ions Ag+ sont réduits en argent métallique selon la demi-équation suivante:
Ag+ + e– ⇆ Ag
Les deux couples d’oxydo-réduction participants à cette transformation sont : Cu2+/Cu et Ag+/Ag .
L’équation bilan d’oxydo-réduction est obtenue en ajoutant membre à membre les deux demi-équations précédentes: